Tình hình sản xuất và tiêu thụ
Theo Dược điển Việt Nam V, chất đối chiếu là chất đồng nhất đã được xác định là đúng, để dùng trong các phép thử quy định về hóa học, vật lý và sinh học, khi xem xét các tính chất của chất cần thử.
Những năm gần đây, với sự phát triển mạnh mẽ của ngành dược, bên cạnh các thuốc tân dược, đã xuất hiện ngày càng nhiều chế phẩm đông dược trên thị trường, đa dạng cả về hình thức lẫn chất lượng. Thêm vào đó, xu hướng sử dụng thuốc nguồn gốc từ dược liệu ngày càng tăng của người tiêu dùng đòi hỏi thuốc nguồn gốc từ dược liệu không chỉ cần đủ, mà còn phải đảm bảo chất lượng. Ngoài các loại dược liệu thật, dược liệu giả, kém chất lượng cũng xuất hiện ngày càng nhiều, nhất là các dược liệu dạng quý, hiếm, có giá trị cao (vì mang lại lợi nhuận lớn cho người bán) sẽ gây nguy hiểm cho sức khỏe của người tiêu dùng.
Hiện nay, đã có khá nhiều phương pháp phân tích hiện đại được đưa vào sử dụng trong thực tế (trong đó, nổi bật là sắc ký lỏng hiệu năng cao). Tuy nhiên, để áp dụng các phương pháp này, một trong những yêu cầu đầu tiên là phải có chất chuẩn. Ở Việt Nam, phần lớn chất chuẩn đang sử dụng chủ yếu phải nhập từ nước ngoài (như chuẩn USP, Chromadex, Wako Pure Chemicals,…) với giá cao và thời gian đặt hàng lâu (vài tuần, thậm chí vài tháng). Bên cạnh hệ thống chất chuẩn do Viện Kiểm nghiệm thuốc Trung ương và Viện Kiểm nghiệm thuốc TP.HCM thiết lập, một số cơ sở nghiên cứu khoa học cũng đã phân lập được chất chuẩn từ dược liệu và sử dụng hạn chế trong phạm vi cơ sở, chưa được thẩm định đầy đủ. Vì vậy hệ thống chất chuẩn với chất lượng cao, đảm bảo kết quả kiểm nghiệm đáng tin cậy và hiệu quả để làm cơ sở kiểm tra chất lượng chế phẩm đông dược và dược liệu làm thuốc, áp dụng rộng rãi được trong phạm vi cả nước sẽ giúp tiết kiệm được nhiều chi phí cũng như thời gian để mua chuẩn từ nước ngoài.
Quy trình và phương pháp thực hiện
Bào chế chất chuẩn acid aleanolic
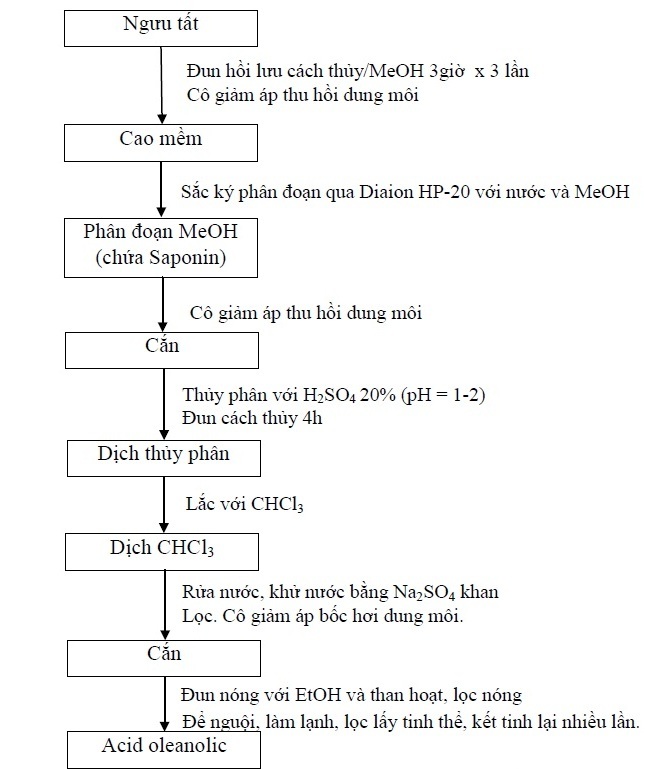
Ngưu tất xắt nhỏ (kích thước lát xắt khoảng 35 mm), chiết hồi lưu nóng bằng MeOH (methanol). Dịch chiết MeOH được cô quay dưới áp suất giảm thu được cao mềm Ngưu tất. Chiết xuất phân đoạn cao Ngưu tất bằng cột Diaion HP-20 với dung môi rửa giải lần lượt là nước cất và MeOH. Kiểm tra sự chiết kiệt các chất trong mỗi phân đoạn bằng TT. H2SO4 20%/EtOH (ethanol) 50% trên bản mỏng sắc ký. Dịch chiết MeOH được gom chung và cô giảm áp để thu được cắn saponin thô toàn phần.
Thủy phân cắn saponin này trong H2SO4 20% (pH = 1-2) bằng cách đun hồi lưu cách thủy trong 4 giờ, để nguội, chiết với CHCl3. Lắc dịch CHCl3 với nước để loại bớt acid. Dịch chiết CHCl3 thu được được khử nước với Na2SO4. Cô giảm áp dịch CHCl3 cho đến cắn.
Kết tinh acid oleanolic bằng cách đun cắn CHCl3 trong EtOH nóng và than hoạt, lọc nóng qua phễu Büchner lấy dịch lọc. Cô cách thủy loại bớt EtOH, để nguội, acid oleanolic kết tinh, lọc lấy tinh thể.
Tinh chế acid oleanolic thô bằng cách kết tinh lại: hoà tan tinh thể acid oleanolic thô vừa kết tinh được trong EtOH nóng cho đến khi tan hoàn toàn, để nguội và làm mát, lọc lấy tinh thể. Kết tinh lại nhiều lần để thu được acid oleanolic tinh khiết.
Kiểm tra độ tinh khiết bằng sắc ký lớp mỏng, hệ dung môi CHCl3-MeOH (95:5), thuốc thử phát hiện H2SO4 10% trong cồn, sấy ở 110oC trong 10 phút. Sau khi thu được acid oleanolic tinh khiết, tiến hành định tính, xác định cấu trúc và thẩm định.
Bào chế chất chuẩn asiaticosid
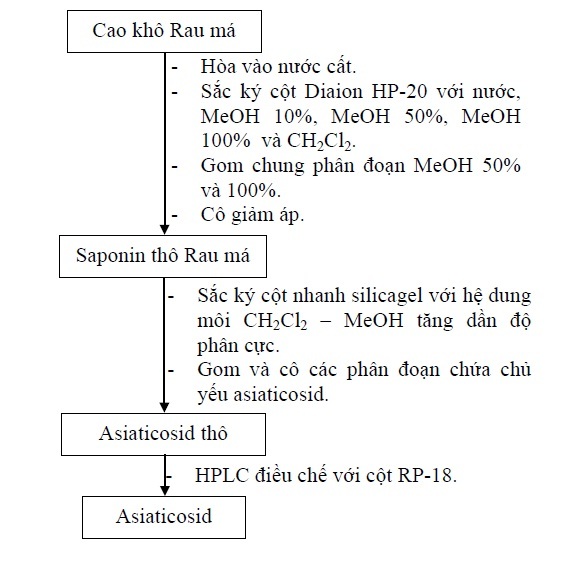
Cao khô rau má được cho qua cột Diaion-HP20, rửa giải lần lượt với MeOH 10%, MeOH 50%, MeOH 100% rồi với dicloromethan. Các phân đoạn MeOH 50% và MeOH 100% được gộp chung, cô thu hồi dung môi dưới áp suất giảm, thu được cắn saponin toàn phần. Cắn này được phân tách bằng cách sử dụng sắc ký cột nhanh với dung môi lên cột là dicloromethan, rửa giải với dung môi dicloromethan–methanol độ phân cực tăng dần, thu lấy các phân đoạn chứa asiaticosid. Cô thu hồi được asiaticosid thô. Asiaticosid thô được tinh chế bằng cách sử dụng sắc ký lỏng cao áp điều chế để thu được asiaticosid tinh khiết.
Điều kiện HPLC điều chế:
- Máy sắc ký: Shimadzu LC 8A
- Cột: Discovery HS C18 (250 x 21,2 mm, 10 µm) + cột bảo vệ C18
- Pha động: MeOH - H2O (6:4)
- Detector: UV 203 nm
- Tốc độ dòng: 20 ml/phút
- Mẫu tiêm: 10 ml (20 mg/ml phân đoạn giàu asiaticosid/pha động)
Sau khi thu được asiaticosid tinh khiết, tiến hành định tính, xác định cấu trúc và thẩm định.
Bào chế chất chuẩn berberin clorid
.jpg)
Berberin clorid được điều chế từ berberin clorid (hàm lượng > 90%) bằng cách kết tinh lại nhiều lần trong EtOH nóng với than hoạt. Sau khi thu được berberin clorid tinh khiết, tiến hành định tính, xác định cấu trúc và thẩm định.
Bào chế chất chuẩn curcumin I
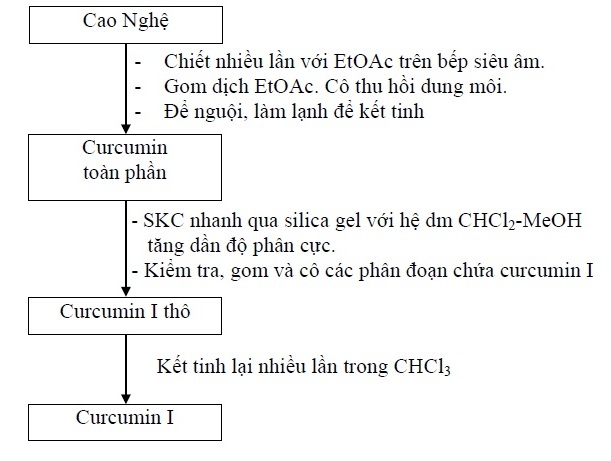
Cao nghệ được chiết nhiều lần với ethyl acetat bằng cách khuấy và đánh siêu âm. Lọc thu lấy dịch ethyl acetat và sau đó loại tạp bằng cách lắc với nước. Gộp tất cả dịch ethyl acetat thu được và cô quay giảm áp thu hồi dung môi, làm lạnh, curcumin toàn phần sẽ kết tinh. Lọc thu lấy hỗn hợp curcumin toàn phần kết tinh. Phân lập curcumin I từ hỗn hợp curcumin toàn phần bằng phương pháp sắc ký cột cổ điển, với hệ dung môi CH2Cl2-MeOH. Kiểm tra và thu lấy phân đoạn có curcumin I, cô quay dưới áp suất giảm thu được curcumin I thô. Curcumin I thô thu được được kết tinh nhiều lần trong cloroform để thu được curcumin I tinh khiết. Sau khi thu được curcumin I tinh khiết, tiến hành định tính, xác định cấu trúc và thẩm định.

Bào chế chất chuẩn diosgenin
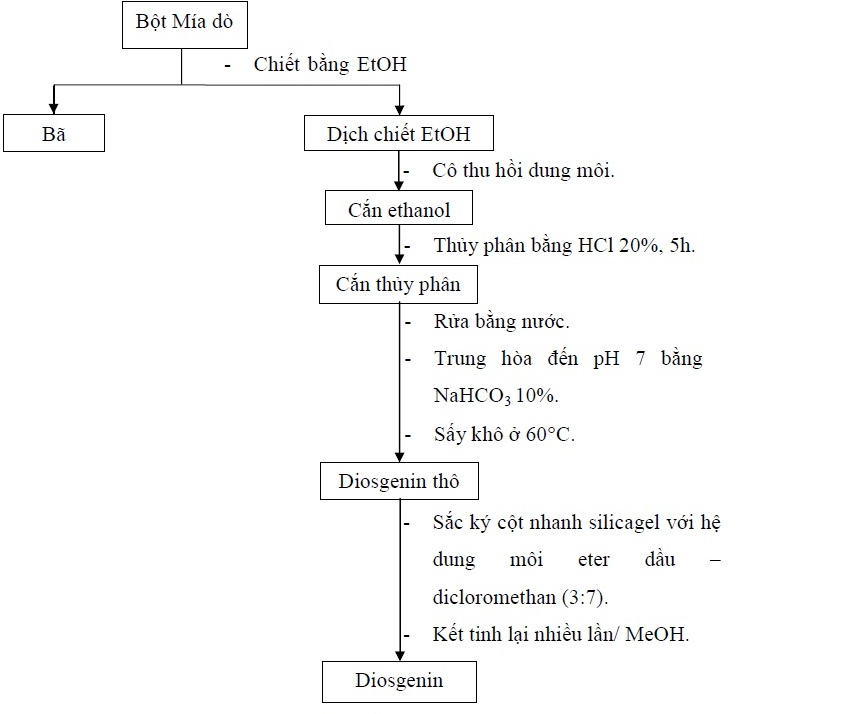
Bột thân rễ Mía dò được chiết hồi lưu với dung môi ethanol 96%. Dịch chiết được lọc, cô chân không đến cắn, thu hồi dung môi. Cắn được thủy phân với HCl 20% trong 5 giờ, tách lấy phần rắn, rửa bằng nước cất và NaHCO3 10% đến pH 7. Tiếp tục sử dụng sắc ký cột nhanh để tách lấy phân đoạn chứa diosgenin với hệ dung môi ban đầu lên cột là ether dầu–dicloromethan (3:7), tiếp tục tăng dần độ phân cực. Diosgenin thô được tinh chế bằng phương pháp kết tinh lại trong methanol. Sau khi thu được diosgenin tinh khiết, tiến hành định tính, xác định cấu trúc và thẩm định.
Bào chế chất chuẩn hesperidin
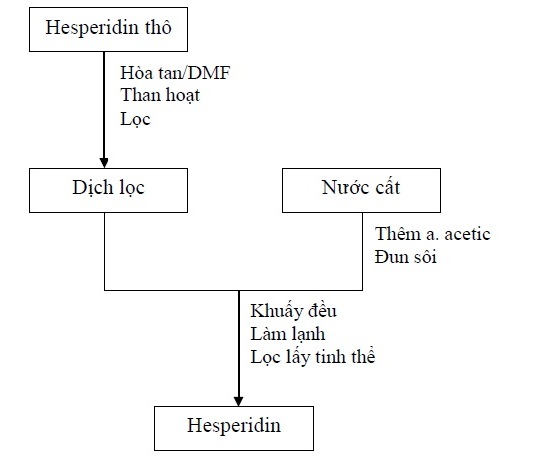
Tinh khiết hóa hesperidin thô (hàm lượng >80%) bằng phương pháp kết tinh lại trong dung môi. Cân 1 g hesperidin thô hòa với 7 ml dimetylformamid, khuấy đều cho tan trong 15 phút. Thêm một ít than hoạt, khuấy đều. Lọc dưới áp suất kém thu được dịch lọc. Đun 20 ml nước cất với 0,5 ml acid acetic đến sôi rồi cho toàn bộ dịch lọc vào. Khuấy đều, làm lạnh, hesperidin sẽ kết tinh. Lọc lấy tinh thể. Lặp lại quá trình kết tinh nhiều lần để thu được hesperidin tinh khiết. Sau khi thu được hesperidin tinh khiết, tiến hành định tính, xác định cấu trúc và thẩm định.
Bào chế chất chuẩn damnacanthal
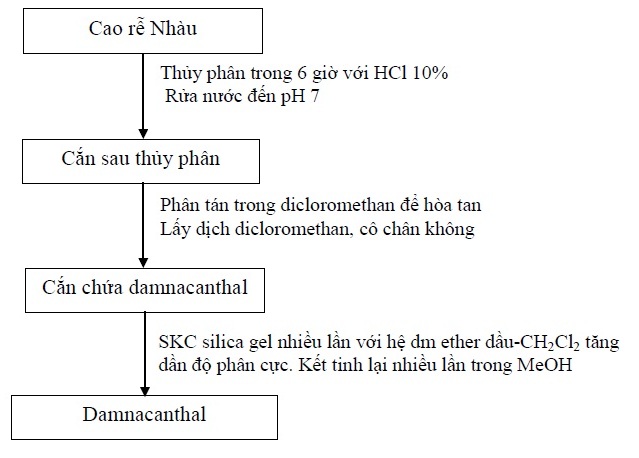
Cao khô rễ Nhàu được thủy phân trong acid HCl 10%, 6 giờ. Cắn còn lại sau thủy phân được rửa với nước đến pH 6-7 và sấy khô dưới áp suất giảm. Ngâm phần cắn này trong dicloromethan, lấy phần dịch dicloromethan cô chân không thu được phần rắn chứa nhiều damnacanthal. Phần rắn này được phân tách bằng sắc ký cột cổ điển và sắc ký cột nhanh với dung môi đầu lên cột là ether dầu–dicloromethan (5:5), tăng dần độ phân cực, thu lấy các phân đoạn chứa damnacanthal thô. Tinh chế các phân đoạn này bằng sắc ký cột, kết hợp với kết tinh trong methanol, thu được damnacanthal tinh khiết. Sau khi thu được damnacanthal tinh khiết, tiến hành định tính, xác định cấu trúc và thẩm định.
Bào chế chất chuẩn ginsenosid-Rg1
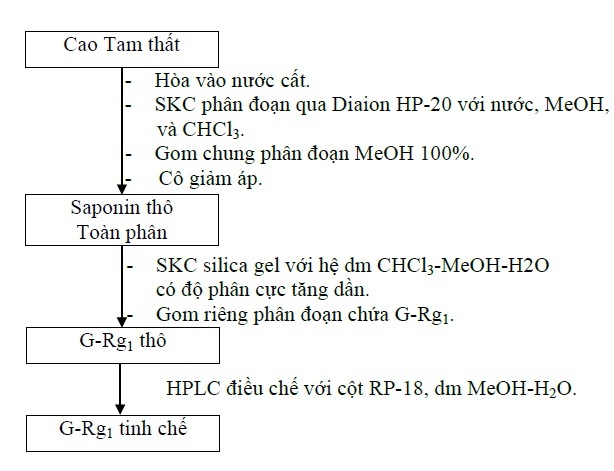
Cao Tam thất (100 g) được loại tạp bằng cách cho qua cột Diaion HP-20 với dung môi rửa giải lần lượt là nước, methanol và chloroform. Thu lấy phân đoạn methanol và cô quay đến cắn để thu được saponin toàn phần.
Tiến hành phân lập các ginsenosid trong saponin toàn phần bằng phương pháp sắc ký cột cổ điển với hỗn hợp dung môi chloroform–methanol tăng dần độ phân cực. Kiểm tra bằng sắc ký lớp mỏng với bản mỏng silica gel F254, dung môi khai triển: CHCl3-MeOH-H2O (65:35:10, lớp dưới), thuốc thử phát hiện: acid sulfuric 20%/ethanol 50%.
Chọn phân đoạn có chứa ginsenosid-Rg1. Thu lấy các phân đoạn này và tiếp tục tiến hành HPLC điều chế để thu ginsenosid-Rg1 tinh khiết. Hứng lấy phân đoạn có xuất hiện pic ginsenosid-Rg1. Dung dịch thu được sau đó tiến hành đông khô và thu lấy hợp chất tinh khiết. Sau khi thu được ginsenosid-Rg1 tinh khiết, tiến hành định tính, xác định cấu trúc và thẩm định.
Điều kiện HPLC điều chế:
- Máy sắc ký: Shimadzu LC 8A
- Cột: Discovery HS C18 (250 x 21,2 mm, 10 µm) + cột bảo vệ C18
- Pha động: MeOH - H2O (6:4)
- Detector: UV 203 nm
- Tốc độ dòng: 20 ml/phút
- Mẫu tiêm: 10 ml (nồng độ 10 mg/ml)
Bào chế chất chuẩn ginsenosid-Rb1
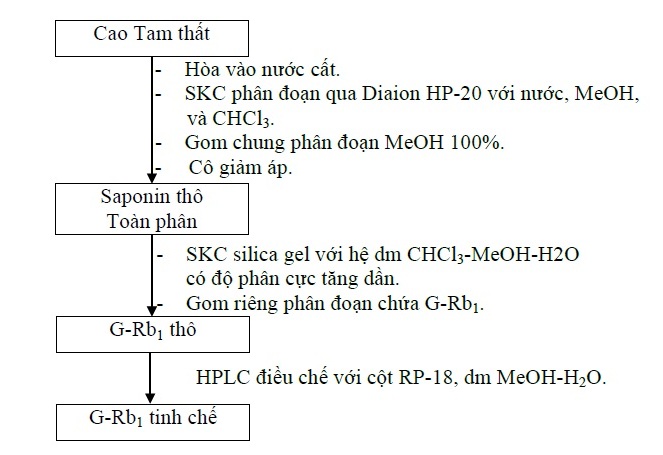
Cao Tam thất (100 g) được loại tạp bằng cách cho qua cột Diaion HP-20 với dung môi rửa giải lần lượt là nước, methanol và chloroform. Thu lấy phân đoạn methanol và cô quay đến cắn để thu được saponin toàn phần. Tiến hành phân lập các ginsenosid trong saponin toàn phần bằng phương pháp sắc ký cột cổ điển với hỗn hợp dung môi chloroform–methanol tăng dần độ phân cực. Kiểm tra bằng sắc ký lớp mỏng với bản mỏng silica gel F254, dung môi khai triển: CHCl3-MeOH-H2O (65:35:10, lớp dưới), thuốc thử phát hiện: acid sulfuric 20%/ethanol 50%. Chọn phân đoạn có chứa ginsenosid-Rb1. Thu lấy các phân đoạn này và tiếp tục tiến hành HPLC điều chế để thu ginsenosid-Rb1 tinh khiết.
Hứng lấy phân đoạn có xuất hiện pic ginsenosid-Rb1. Dung dịch thu được sau đó tiến hành đông khô và thu lấy hợp chất tinh khiết. Sau khi thu được ginsenosid-Rb1 tinh khiết, tiến hành định tính, xác định cấu trúc và thẩm định.
Điều kiện HPLC điều chế
- Máy sắc ký: Shimadzu LC 8A
- Cột: Discovery HS C18 (250 x 21,2 mm, 10 µm) + cột bảo vệ C18
- Pha động: MeOH - H2O (6:4)
- Detector: UV 203 nm
- Tốc độ dòng: 20 ml/phút
- Mẫu tiêm: 10 ml (nồng độ 10 mg/ml)
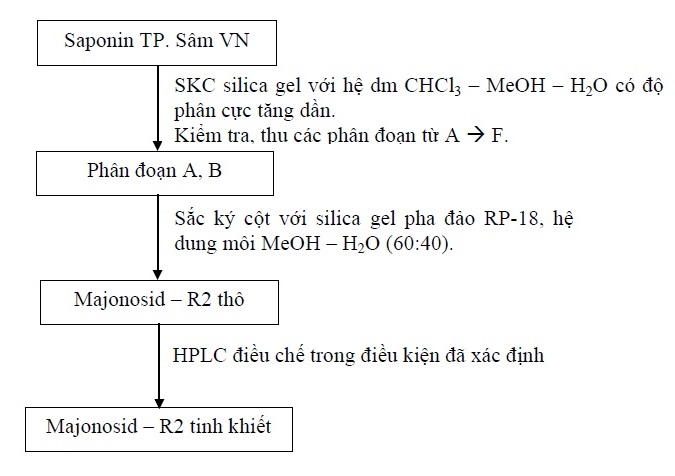
Bào chế chất chuẩn majonosid – R2
Sắc ký saponin toàn phần Sâm Việt Nam trên silica gel, bằng các hệ dung môi có độ phân cực tăng dần CHCl3–MeOH (30:20), CHCl3–MeOH (65:35), CHCl3–MeOH–H2O (65:35:2), CHCl3–MeOH–H2O (65:35:5), CHCl3–MeOH–H2O (65:35:10; lớp dưới).
Các phân đoạn tách ra được kiểm tra bằng sắc ký lớp mỏng với hệ dung môi CHCl3-MeOH-H2O (65:35:10; lớp dưới), phát hiện vết bằng thuốc thử là dung dịch acid sulfuric 20%/EtOH 50%. Các phân đoạn giống nhau được gộp chung, cô quay đến cắn, thu được 7 phân đoạn lớn, ký hiệu A, B, C, D, E, F.
Phân đoạn A, B thu được ở trên được gom chung và sắc ký qua cột sắc ký pha đảo với silica gel RP18 với hệ dung môi MeOH–H2O (60:40). Majonosid-R2 thu được dưới dạng bột màu trắng. MR2 thu được kiểm tra trên HPLC nếu thấy còn lẫn chất khác nhất là ginsenosid Rg1 tiếp tục được tinh chế bằng phương pháp HPLC. Sau khi thu được majonosid–R2 tinh khiết, tiến hành định tính, xác định cấu trúc và thẩm định.
Điều kiện HPLC điều chế
- Máy sắc ký: Shimadzu LC 8A
- Cột: Discovery HS C18 (250 x 21,2 mm, 10 µm) + cột bảo vệ C18
- Pha động: MeOH - H2O (6:4)
- Detector: UV 203 nm
- Tốc độ dòng: 20 ml/phút
- Mẫu tiêm: 10 ml (nồng độ 10 mg/ml)
Ưu điểm của công nghệ, hiệu quả kinh tế
Các quy trình bào chế 10 chất chuẩn có độ ổn định và tính lặp lại cao, có thể áp dụng hiệu quả vào việc sản xuất các chất chuẩn. Đặc biệt, phương pháp HPLC điều chế đã được áp dụng một cách hiệu quả để tinh chế asiaticosid, ginsenosid-Rb1, ginsenosid-Rg1, majonosid-R2,…giúp tiết kiệm thời gian, chi phí và thu được các chất chuẩn có độ tinh khiết cao. Các quá trình điều chế này còn thu được các phân đoạn giàu chất hoặc các hợp chất đã tách khá sạch như nordamnacanthal, acid asiatic, madecassosid,…Các phân đoạn hoặc các chất này sẽ được tiếp tục sử dụng để điều chế chất chuẩn, làm tăng số lượng chất chuẩn dùng trong nghiên cứu, kiểm nghiệm dược liệu và đông dược.
Quy trình thiết lập các chất chuẩn gốc áp dụng đầy đủ các tiêu chí đánh giá, bao gồm xác định bộ dữ liệu hóa lý (điểm chảy, các phổ UV, IR, NMR và MS), đánh giá tạp chất, định tính, định lượng, xác định độ đồng nhất giữa các lọ chuẩn trong một lô và thẩm định liên phòng thí nghiệm độc lập, đạt tiêu chuẩn GLP/ISO. Kết quả thẩm định liên phòng thí nghiệm cho thấy, 10 chất chuẩn đã thiết lập có chất lượng cao, đáng tin cậy, đạt TCCS của chất chuẩn gốc. Các chất chuẩn gốc được thực hiện theo quy trình này có thể đăng ký chất chuẩn quốc gia khi có quy định cụ thể.
Sản phẩm đã được sản xuất và đưa vào thị trường. Kết quả cho thấy triển vọng mang lại nguồn thu cao từ sản phẩm, phục vụ tốt công tác nghiên cứu, tiêu chuẩn hóa và kiểm nghiệm, qua đó góp phần nâng cao chất lượng dược liệu và đông dược.
Cụ thể:
Thông tin về 10 chất chuẩn đã thiết lập:
|
TT
|
Chất chuẩn
|
Khối lượng (g)/chỉ tiêu dự án (g)
|
Hàm lượng nguyên trạng (%)
|
Số lọ
đóng được
|
Lượng còn lại (g)
|
Thẩm định liên phòng thí nghiệm
|
|
1
|
Acid oleanolic
|
10,77/10
|
105,07
|
100 lọ x 10 mg
|
9,77
|
Đạt
|
|
2
|
Asiaticosid
|
10,44/10
|
98,64
|
100 lọ x 10 mg
|
9,44
|
Đạt
|
|
3
|
Berberin clorid
|
10,93/10
|
93,73
(101,8%
khan)
|
100 lọ x 20 mg
|
8,93
|
Đạt
|
|
4
|
Curcumin I
|
11,97/10
|
98,90
|
100 lọ x 20 mg
|
9,97
|
Đạt
|
|
5
|
Damnacanthal
|
11,87/10
|
99,78
|
100 lọ x 10 mg
|
10,87
|
Đạt
|
|
6
|
Diosgenin
|
15,54/10
|
98,68
|
100 lọ x 10 mg
|
14,54
|
Đạt
|
|
7
|
Hesperidin
|
10,67/10
|
94,43
|
100 lọ x 10 mg
|
6,67
|
Đạt
|
|
8
|
Ginsenosid-Rb1
|
3,50/2
|
99,17
|
100 lọ x 10 mg
|
2,50
|
Đạt
|
|
9
|
Ginsenosid-Rg1
|
3,30/2
|
96,43
|
100 lọ x 10 mg
|
2,30
|
Đạt
|
|
10
|
Majonosid-R2
|
1,09/1
|
98,86
|
80 lọ x 10 mg
|
0,29
|
Đạt
|
Tổng giá trị lượng chất chuẩn đã sản xuất:
|
TT
|
Tên chất đối chiếu
|
Chủng
loại
|
Giá phân
phối 10 mg (*)
|
Khối lượng
sản xuất (g)
|
Tổng giá trị
(*)
|
|
1
|
Acid oleanolic
|
P
|
500.000
|
10,48
|
524.000.000
|
|
2
|
Asiaticosid
|
P
|
1.200.000
|
10,09
|
1.210.800.000
|
|
3
|
Berberin chlorid
|
P
|
500.000
|
10,35
|
517.500.000
|
|
4
|
Curcumin I
|
P
|
500.000
|
11,39
|
569.500.000
|
|
5
|
Damnacanthal
|
P
|
500.000
|
11,52
|
576.000.000
|
|
6
|
Diosgenin
|
P
|
500.000
|
15,19
|
759.500.000
|
|
7
|
Hesperidin
|
P
|
500.000
|
10,32
|
516.000.000
|
|
8
|
Ginsenosid-Rb1
|
P
|
2.500.000
|
3,21
|
802.500.000
|
|
9
|
Ginsenosid-Rg1
|
P
|
2.500.000
|
3,01
|
752.500.000
|
|
10
|
Majonosid-R2
|
P
|
3.000.000
|
0,74
|
222.000.000
|
|
Tổng giá tiền
|
6.450.300.000
|
(*) Đơn vị tính: đồng Việt Nam. Giá bán chất chuẩn đã thiết lập chỉ bằng 1/3–1/2 chất chuẩn nhập, chưa kể chi phí vận chuyển và thuế.
Thông tin liên hệ chuyên gia, hỗ trợ
1. GS.TS Nguyễn Minh Đức
ĐT: 0908 988 820. Email: nguyenminhduc@tdt.edu.vn
2. Trung tâm Khoa học công nghệ Dược Sài Gòn
Địa chỉ: 41 Đinh Tiên Hoàng, phường Bến Nghé, quận 1, TP.HCM. Điện thoại: 028.38295641.